Laju Reaksi
Laju reaksi
adalah istilah yang digunakan untuk menyatakan cepat lambatnyasuatu reaksi
imia. Cabang ilmu kimia yang husus mempelajari laju reaksi disebut kinetika
kimia.
A. Molaritas
1. Penertian
Molariras
Molaritas adalah suatu
konsentrasi larutan yang menyatakan jumlah mol zat terlarut dalam 1 liter
larutan. Molaritas sama dengan jumlah mol (n) zat terlarut dibagi dengan volume
(v) larutan.
2. Pengenceran
Pengenceran adalah
menurunkan atau memperkecil konsentrasi larutan dengan menambahkan pelarut. Dalam
hal ini, konsentrasi yang digunakan adalah Molaritas (M). Pada proses
pengencern, volume dan molaritasnya berubah, sedangkan jumlah molnya tetap.
Oleh karena itu, berlaku rumus :
V1M1
= V2M2
keterangan :
V1 :
volume larutan sebelum diencerkan (Latau mL)
M1 : molaritas larutan sebelum diencerkan
V2 :
volume larutan setelah diencerkan (Latau mL)
M2 :
molaritas larutan setelah diencerkan
3. Pencampuran
Pencampuran melibatkan dua atau lebih zat yang
jenisnya sama, tetapi konsentrasinya berbeda. Dalam hal ini, konsentrasi yang
digunaan adalah molaritas (M).
Mc  V1M1+ V2M2
+ V3M3 + …/V1+V2+V3
untuk pencampuran beberapa zat sejenis
V1M1+ V2M2
+ V3M3 + …/V1+V2+V3
untuk pencampuran beberapa zat sejenis
Mc  V1M1+ V2M2
/ V1+V2
V1M1+ V2M2
/ V1+V2
B.
Konsep
Laju eaksi
A
+ B AB
AB
rA aalah
laju pengurangan konsentrasi zat A tiap satuan waktu = 
rB aalah
laju pengurangan konsentrasi zat B tiap satuan waktu = 
rAB aalah
laju pengurangan konsentrasi zat AB tiap satuan waktu = 
Konsentrasi yang
digunakan dalam laju reasi molaritas (M) yang stuannya Moar atau mol/L,
sehingga satuan laju reaksi adalah M  det-1
det-1
C. Teori Tumbukan
1.
Energi Aktivitasi untuk Reaksi Eksoterm
Persamaa
: Reaktan  Produk ;
Produk ; 
Gambar
2.
Energi Aktivitasi untuk Reaksi Endoterm
Persamaa
: Reaktan  Produk ;
Produk ; 
D. Faktor – Faktor yang Mmengaruhu Laju
Reaksi
1. Sifat Dasar Zat
Sifat dasar zat ada
yang berlangsung cepat dan ada pula yang berlangsung lambat.
2.
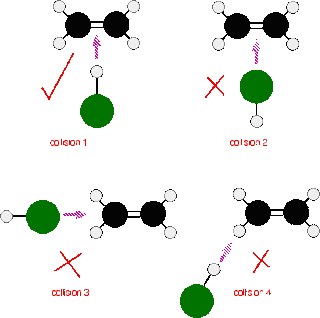
Konsentrasi
Makin banyak partikel
reaktan yang bertumbukan secara efektif, laju reaksi semakin besar.
Gambar
3.
Luas Permukaan Bidang Sentuh
Makin luas permukaan
bidang sentuh, laju reaksi juga akan semakin besar.
Gambar
4.
Temperatur
Umumnya, setiap
kenaikan temperature 10 C, laju reaksi menjadi
dua kali lebih besar dari laju reaksi mula – mula.
C, laju reaksi menjadi
dua kali lebih besar dari laju reaksi mula – mula.
rT = r0  2n ; n = T –
T0 / 10
2n ; n = T –
T0 / 10
hubungan laju reaksi
dengan waktu :
tT = t0  2-n ; n = T
– T0 / 10
2-n ; n = T
– T0 / 10
5.
Katalis
a.
Pembentukan Senyawa Antara (Katalis
Homogen)
Dicari katalis yang
dapat bereaksi baik dengan partikel zat yang miskin energi maupun yang kaya
enerfinuntuk membentuk senyawa antara, kemudian bereaksi membentuk zat yang
diinginkan.
b.
Cara Kerja Katalisatorengan Proses
Adsorbsi (Katalis Heterogen)
Dalam hal ini,
katalisator berwujud padat yang mampu mengikatsejumlah gas atau cairan dari
partikel zat reaktan pada permukaan katalisator.
Untu lebih memahami mengenai
factor- factor yang mempengatruhi laju reaksi, silahkan anda lihat eksperimen
berikut.










0 komentar:
Posting Komentar